1/a. Les maladies pouvant être traitées
→ les maladies pouvant être traitées
C’est en septembre 1990 qu’a été pratiquée la première thérapie génique dans le monde. Cet essai mené aux National lnstitute of Health américains (NIH), par les médecins Anderson et Blaese, concernait une petite fille de trois ans atteinte d’un syndrome génétique rare et grave, le déficit en adénosine désaminase (ADA).
Toutes les formes de maladies peuvent être traitées à différentes échelles en modifiant l'expression du gène. Généralement on imagine que la thérapie génique est destinée à guérir les maladies héréditaires, comme par exemple : les distrophies musculaire, la mucoviscidose, le diabéte de type I ou bien les troubles du métabolisme, l'hémophilie, les myopathies, certains cancers, l'immunodéficiences...
→ les moyens de traiter maladies
Comment les gènes sont-ils insérés dans les cellules cibles ?
Il existe trois grands moyens d'administrer les vecteurs* pour qu'ils transportent de nouveaux
gènes dans les cellules cibles :
la thérapie de la lignée somatique ex vivo, par laquelle les cellules
cibles sont enlevées du corps, cultivées en laboratoire avec un vecteur, puis réinsérées dans le
corps. En général, ce processus est réalisé à l'aide de cellules sanguines, car ce sont les plus faciles à
enlever et à réintroduire.
La lignée somatique in suto, consiste à placer le vecteur directement dans le tissu touché. Ce
processus est employé pour traiter la mucoviscidose, (par infusion directe du vecteur dans les
bronches des poumons), détruire les tumeurs (exemple le cancer du cerveau) et traiter la
dystrophie musculaire.
La thérapie de la lignée somatique in vivo, par laquelle le vecteur est injecté dans le courant
sanguin et peut trouver et insérer de nouveaux gènes uniquement dans les cellules pour lesquelles
il a été spécialement conçu. Bien qu'il n'existe actuellement aucun traitement in vivo disponible,
une percée dans ce domaine rendra la thérapie génique forte attrayante
Les vecteurs utilisés en thérapie génique peuvent être répartis en deux catégories : les vecteurs viraux et les vecteurs non viraux.
Vecteurs viraux
On met au point des virus à ADN* et à ARN* qui servent de vecteur en thérapie génique. Les virus constituent d'excellents vecteurs, car au terme de longues périodes d'évolution, ils ont acquis la capacité d'éviter d'être détruits par le système immunitaire humain et d'insérer leur propre matériel génétique dans des cellules humaines. Les virus sont composés de matériel génétique entouré d'une couche protectrice formée de protéines*. Normalement, un virus infecte une cellule lorsque son matériel génétique s'y introduit. Une fois que le matériel génétique viral se trouve à l'intérieur, il «prend les commandes» de la machine à fabriquer les protéines et l'ADN de la cellule, la faisant produire de nouveaux virus. C'est la couche virale protectrice extérieure qui permet au matériel génétique interne de pénétrer dans la cellule. Cette couche extérieure détermine également le type de cellules qu'un virus donné infectera. Pour piéger le virus, les scientifiques gardent la couche virale extérieure, mais modifient le matériel génétique interne. Ils enlèvent les gènes toxiques et les remplacent par des gènes thérapeutiques. Maintenant, le virus n'est plus pathogène et est incapable de se reproduire. Toutefois, il demeure capable de transférer son matériel génétique aux cellules pour lesquelles sa couche extérieure a été conçue. Le transfert de matériel génétique au moyen d'un vecteur viral s'appelle transduction*
Vecteurs rétro-viraux
Les rétrovirus ont pour matériel génétique de l'ARN*. Ces virus comportent également un enzyme spécial qui, une fois dans la cellule, fabrique de l'ADN double brin en utilisant comme matrice l'ARN du virus. Le nouvel ADN s'intègre au génome de la cellule hôte. Lorsque les « nouveaux » gènes chromosomiques sont transcrits, de nouvelles particules de virus sont fabriquées, lesquelles quitteront la cellule pour en infecter d'autres. L’utilisation des rétrovirus présente moins de risque que celle de certains autres virus (déjà moins nocifs sous leur forme naturelle que les autres). Le virus de la leucémie murine (de souris) constitue l'un des rétrovirus les plus couramment employés comme vecteur rétroviral. Les gènes de reproduction du rétrovirus sont remplacés par le gène thérapeutique. Lorsque le virus infecte la cellule, le gène thérapeutique s'intègre aux chromosomes de la cellule. Le nouveau gène entraîne la production d'une protéine qui, on l'espère, aura certains effets thérapeutiques bénéfiques, soit en produisant la protéine jusqu'alors manquante ou en détruisant les cellules nocives. cf. schéma 1
Un virus doit se lier à certaines molécules réceptrices en surface pour pénétrer dans la cellule. À cette fin, les rétrovirus possèdent des protéines sur l'enveloppe extérieure qui s'adaptent parfaitement à certains récepteurs sur certaines cellules. Le virus de la leucémie murine se lie aux cellules contenant un récepteur appelé récepteur amphotropique.
Vecteurs adénoviraux
Les adénovirus sont des virus d'ADN capables de transduire un grand nombre de types de cellules, y compris les cellules qui ne sont pas en voie de division. Les adénovirus sont également capables de transporter de longs segments d'information génétique ajoutée. Par ailleurs, il est assez facile de produire de grandes quantités d'adénovirus en culture. Les adénovirus, dans leur forme naturelle, ne sont pas très nocifs. Leur utilisation en tant que vecteur est donc relativement sûre. C'est pourquoi les adénovirus sont actuellement les vecteurs d'ADN les plus utilisés pour des expériences en thérapie génique in situ (actuellement des recherches à l'aide de vecteurs adénoviraux pour le traitement de plusieurs cancers et de la fibrose kystique.) La grandeur de la capside des adénovirus est juste suffisante pour que l'ADN viral original puisse y pénétrer. Pour chaque nouveau gène thérapeutique à insérer dans le génome viral, il faut enlever un segment correspondant de l'ancien ADN viral. Pour faire de la place pour le nouvel ADN thérapeutique, une région de l'ancien ADN viral appelée E3 est parfois enlevée. Mais l’enlèvement de la région E3 n’est pas sans conséquence, car celle-ci code pour une protéine qui supprime la réaction immunitaire de l'homme contre le vecteur. Les vecteurs adénoviraux envoient leur ADN au noyau, mais l'ADN ne s'intègre pas dans les chromosomes des cellules hôtes. C'est pourquoi l'ADN viral a une durée de vie limitée dans la cellule avant sa dégradation, ce qui signifie que les gènes ajoutés ne sont efficaces que temporairement. Le traitement de maladies chroniques comme la fibrose kystique devrait donc être répété régulièrement. En revanche, la nature éphémère de l'expression du gène thérapeutique est utile lorsque les gènes ajoutés sont requis temporairement pour induire une réaction immunitaire à un cancer ou à un agent pathogène.
Vecteurs non viraux
L'utilisation de vecteurs non viraux peut nécessiter une injection directe d'ADN plasmidique ou le mélange d'ADN plasmidique avec des composés qui lui permettent de traverser la membrane cellulaire et d'empêcher l'ADN de se dégrader. Ces méthodes sont actuellement moins efficaces que l'utilisation de vecteurs viraux. Toutefois, contrairement aux virus désactivés qui peuvent changer spontanément et provoquer une maladie, les vecteurs non viraux ne possèdent aucun gène viral et ne peuvent donc provoquer aucune maladie.
Utilisation de liposomes
Les liposomes sont de petites vésicules creuses de molécules lipidiques (de graisses) capables de véhiculer de l'ADN en elles. Un liposome peut fusionner avec la membrane cellulaire, libérant son contenu dans la cellule. L'ADN plasmidique contenant le gène thérapeutique est incubé avec les liposomes vides dans certaines conditions. Les liposomes contenant l'ADN plasmidique s'appellent lipoplexes*. Les lipoplexes peuvent ensuite pénétrer dans les cellules ciblées et y introduire l'ADN thérapeutique. Les lipoplexes ne sont pas aussi efficaces que les vecteurs viraux pour introduire des gènes dans des cellules. Pour améliorer leur efficacité, les scientifiques tentent d'intégrer certaines protéines virales dans les surfaces extérieures des lipoplexes, en particulier, les protéines virales qui reconnaissent certaines molécules à la surface de la cellule hôte et s'y lient.
Le saut d'exon
La mutation du gène est corrigée avant qu'il soit transformé en protéine. Un gène muté produit une protéine non-fonctionnelle. La technique du saut d'exon propose de corriger l'erreur entre le moment où le gène est transcrit en un ARN brut dit prémessager et celui où il devient un ARN messager qui sera traduit par la protéine. C'est lors de cette étape que les séquences inutiles (introns) sont supprimées pour ne laisser que les morceaux codants (les exons). Cette révolution dans l'histoire des sciences est du à Luis Garcia et Olivier Danos
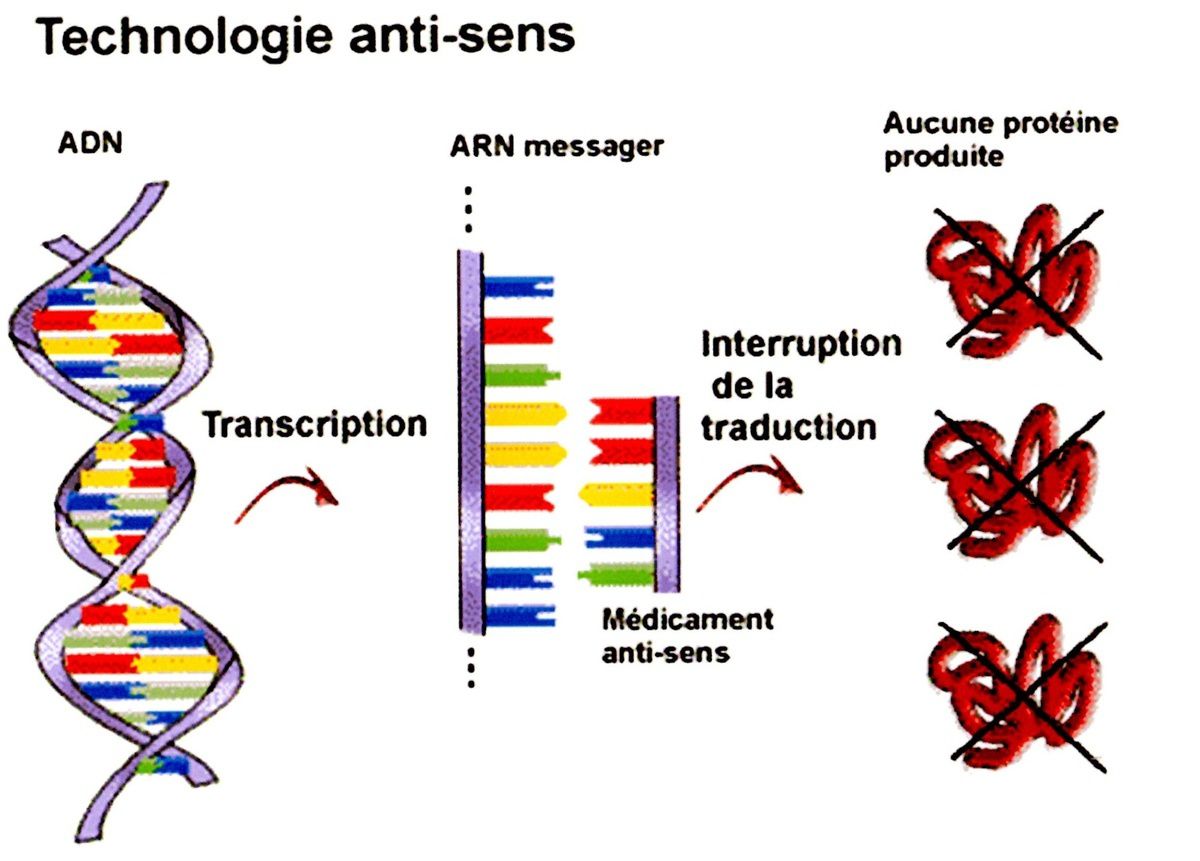
Technologie anti-sens
L'une des applications possibles de la technologie anti-sens consiste à empêcher les virus qui infectent une cellule hôte de produire leurs propres protéines, ce qui, à son tour, préviendrait leur reproduction. Les médicaments anti-sens interagissent avec l'ARN messager, l'empêchant d'être traduit en la protéine correspondante. Un médicament anti-sens est un oligonucléotide* (une chaîne monocaténaire relativement petite de nucléotides) complémentaire à un petit segment de la molécule cible d'ARN messager. Lorsque le médicament entre en contact avec son ARN messager complémentaire, il se lie à l'ARN messager comme se lient les deux brins d'une molécule d'ADN. Ceci rend l'ARN messager illisible pour le ribosome, et aucune protéine n'est produite. cf. schéma 2
À la fin du mois d'août 1998, la Food and Drug Administration (FDA) des États-Unis a
approuvé un médicament appelé formivirsen pour le traitement de la rétinite à cytomégalovirus
chez les personnes atteintes du sida. Il s'agit du premier médicament antisens sur le marché. Le
formivirsen empêche la reproduction du cytomégalovirus qui provoque la rétinite, infection
oculaire entraînant la cécité et touchant principalement les personnes atteintes du sida. Le
médicament est injecté régulièrement dans l'oeil du patient et n'a apparemment que de légers
effets secondaires comparativement à d'autres médicaments antiviraux

/http%3A%2F%2Fi2.ytimg.com%2Fvi%2FASimR-F0iPc%2Fhqdefault.jpg)
/image%2F0485011%2F201303%2Fob_bd1174184d52d0805e8fa3ff10e69059_the.jpg)
/image%2F0485011%2F201303%2Fob_6a9e3632de5478d1384a7ee9a15dff04_essais-clinique.png)
/image%2F0485011%2F201303%2Fob_e185c3ce6396dc286d22dd1db834da81_afm.png)
/image%2F0485011%2F201303%2Fob_8f1640cc0c7ce7ea2fa27ae21c802f6b_ther.jpg)
/https%3A%2F%2Fassets.over-blog.com%2Ft%2Fdelicate%2Fimages%2Fheader%2Fheader.jpg)
/image%2F0485011%2F201303%2Fob_7344f4_plus-de-la-moitie-des-tissus-cicatriciels-peuvent.jpg)
/image%2F0485011%2F201303%2Fob_3ce863_primeur-therapie-genique-maladie-de-parkinson-pri.jpg)
/image%2F0485011%2F201303%2Fob_ef5ae06d63dc94255840483c6b09b508_telechargement-cc.jpg)




/http%3A%2F%2Fi2.ytimg.com%2Fvi%2FASimR-F0iPc%2Fhqdefault.jpg)
/image%2F0485011%2F201303%2Fob_6a9e3632de5478d1384a7ee9a15dff04_essais-clinique.png)
/image%2F0485011%2F201303%2Fob_e185c3ce6396dc286d22dd1db834da81_afm.png)
/image%2F0485011%2F201303%2Fob_8f1640cc0c7ce7ea2fa27ae21c802f6b_ther.jpg)